كيفية تسمية المركبات الكيميائية
مؤلف:
Laura McKinney
تاريخ الخلق:
2 أبريل 2021
تاريخ التحديث:
26 يونيو 2024

المحتوى
- مراحل
- طريقة 1 من 3: تسميات المركبات الأيونية
- طريقة 2 من 2: تسميات المركبات متعددة الذرات
- طريقة 3 من 3: تسميات المركبات التساهمية
يتطلب النجاح في مجال الكيمياء معرفة كيفية تسمية المركبات الكيميائية الأساسية. يوفر لك هذا الدليل القواعد الأساسية المتعلقة بعملية تسمية المركبات الكيميائية وكيفية تعيين أسماء للمركبات غير المألوفة بالنسبة لك.
مراحل
طريقة 1 من 3: تسميات المركبات الأيونية
- ما هو المركب الأيوني؟ تتكون المركبات الأيونية من معدن وغير معدني. ثم راجع الجدول الدوري للعناصر لمعرفة الفئات التي تنتمي إلى العناصر الموجودة في المركب.
-

شكل الاسم. ليس هناك ما هو أسهل من تسمية مركب أيوني مكون من عنصرين. في الواقع ، يتوافق الجزء الأول من اسم المركب مع اسم العنصر غير المعدني الذي يحمل اللاحقة "ure" بينما يتوافق الجزء الثاني مع اسم العنصر المعدني. هناك استثناءات: أكسيد ، فوسفيد ، نيتريد ، كبريتيد.- مثال:2O3. الله2 = الألومنيوم O3 = الأكسجين. وبالتالي فإن اسم المركب هو "أكسيد الألومنيوم".
-
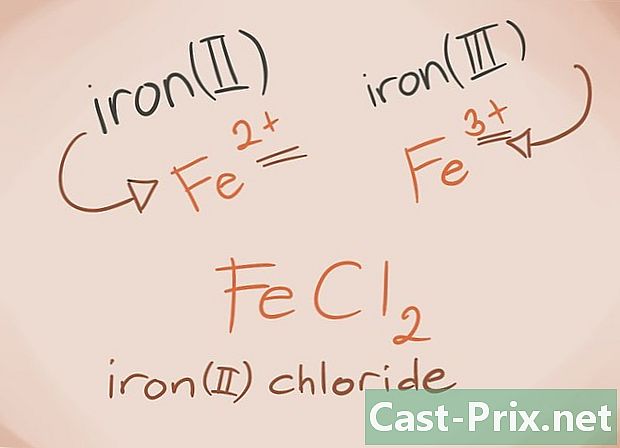
تعرف على الفلزات الانتقالية ، الفلزات الانتقالية هي تلك الموجودة في الفدرين D و F بالجدول الدوري. في اسم المركب ، تتم كتابة رسوم هذه المعادن بالأرقام الرومانية. وذلك لأن الفلزات الانتقالية يمكنها حمل المزيد من الحمل وتشكيل المزيد من المركب.- مثال: FeCl2 و FeCl3. الحديد = الكلورين2 = -2 كلوريد الكلورين3 = كلوريد -3. كأسماء ، سيكون هناك كلوريد الحديد (II) وكلوريد الحديديك (III).
طريقة 2 من 2: تسميات المركبات متعددة الذرات
-

تحتاج إلى فهم ما هو مركب متعدد الذرات. المركبات متعددة الذرات هي مركبات تتكون من مجموعة من البيانات المسجلة مع بعضها البعض. المجموعة بأكملها تحمل شحنة إيجابية أو سلبية. ثم هناك ثلاثة إجراءات أساسية يمكنك ممارستها على مركبات متعددة الذرات:- يمكنك إضافة الهيدروجين إلى الجزء الأول من المجمع. تتم إضافة كلمة "الهيدروجين" بالفعل في بداية اسم المركب. هذا سوف يقلل من قيمة الشحنة السلبية بمقدار واحد. على سبيل المثال ، "كربونات" CO3 يصبح "كربونات الهيدروجين" HCO3.

- يمكنك أيضًا إزالة الأكسجين من المركب. لا يتم تغيير الحمل ، ولكن يتم تغيير لاحقة "-ate" للمركب إلى "-ique". على سبيل المثال تحول: NO3 في لا2 نذهب من نترات إلى نترات. "

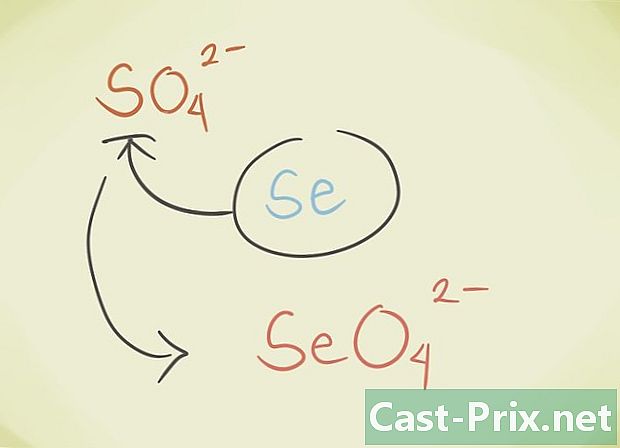
- يمكنك استبدال latome المركزي للمركب بذرة أخرى تنتمي إلى نفس المجموعة الدورية. على سبيل المثال ، كبريتات SO4 يمكن استبداله بواسطة Selenate SeO4.
- يمكنك إضافة الهيدروجين إلى الجزء الأول من المجمع. تتم إضافة كلمة "الهيدروجين" بالفعل في بداية اسم المركب. هذا سوف يقلل من قيمة الشحنة السلبية بمقدار واحد. على سبيل المثال ، "كربونات" CO3 يصبح "كربونات الهيدروجين" HCO3.
-

حفظ المجموعات الأكثر شيوعا ديون. تستخدم المجموعات أدناه لتشكيل معظم المركبات متعددة الذرات. بعد الترتيب المتزايد لشحنتهم السلبية ، لدينا:- أيونات الهيدروكسيد: OH
- أيونات النترات: لا3
- أيونات كربونات الهيدروجين: HCO3
- أيونات برمنجنات: MnO4
- أيونات الكربونات: CO3
- أيونات كرومات: كرو4
- أيونات ثنائي كرومات: كر2O7
- أيونات الكبريتات: SO4
- أيونات الكبريتيت: SO3
- أيونات الثيوسلفات: S2O3
- أيونات الفوسفات: ص4
- أيونات الأمونيوم: NH4
- قم بتكوين أسماء مركبة من القائمة أعلاه. تشكيل ارتباط اسم مع أي من العناصر المتعلقة بالمجموعة. إذا تم وضع العنصر قبل المجموعة الأيونية ، فسيتم ببساطة إضافة اسم العنصر إلى بداية اسم المركب.
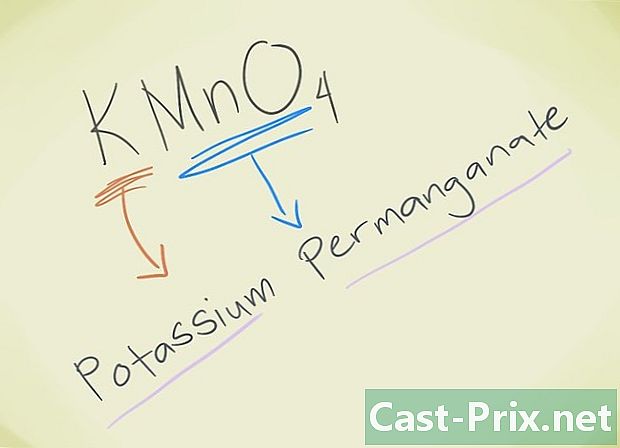
- مثال: KMnO4. يجب أن تكون قادرًا على معرفة ذلك الأسد MnO4 يتوافق مع برمنجنات الأسد. K يشير إلى البوتاسيوم. لذلك سوف يطلق على مركبك برمنجنات البوتاسيوم.
- مثال: هيدروكسيد الصوديوم. ربما تكون قد فهمت هنا أنه من OHOH. Na عبارة عن صوديوم ، لذلك سيطلق على المركب هيدروكسيد الصوديوم.

- مثال: KMnO4. يجب أن تكون قادرًا على معرفة ذلك الأسد MnO4 يتوافق مع برمنجنات الأسد. K يشير إلى البوتاسيوم. لذلك سوف يطلق على مركبك برمنجنات البوتاسيوم.
طريقة 3 من 3: تسميات المركبات التساهمية
-
ما هو المركب التساهمي؟ تنجم المركبات التساهمية عن ارتباط عنصرين غير معدنيين على الأقل. يتم تحديد اسم المركب حسب عدد البيانات التي تشكله. تشير البادئة اليونانية بجانب هذا الاسم إلى عدد الجزيئات الموجودة في المركب. -
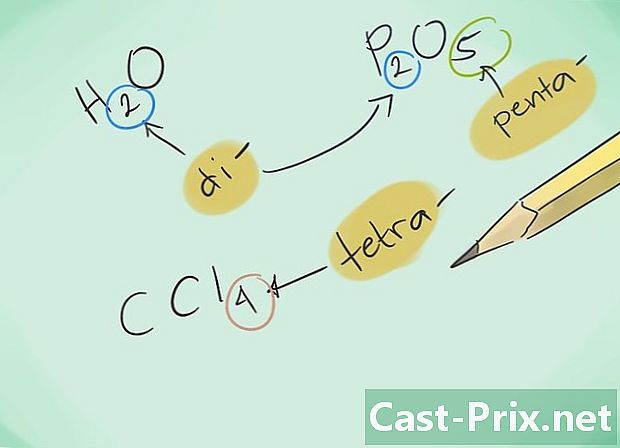
تعرف على البادئات. استظهر البادئات التالية للمركبات من 1 إلى 8 ذرات:- ذرة واحدة - "أحادي"
- ذرتان - "دي"
- 3 ذرات - "ثلاثي"
- 4 ذرات - "تترا"
- 5 ذرات - "بنتا"
- 6 ذرات - "سداسي"
- 7 ذرات - "هيبتا"
- 8 ذرات - "Octa-"
- ثم اسم المركبات. اسم المركب الناتج باستخدام البادئات المناسبة. يجب تطعيم البادئات على كل عنصر من العناصر المكونة لمركب به عدة ذرات.
- مثال: CO سيعود إلى أول أكسيد الكربون بينما CO2 سيعين ثاني أكسيد الكربون.
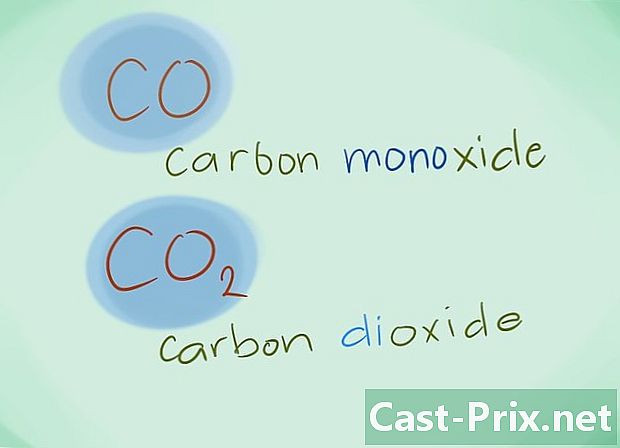
- مثال: N2S3 سوف تتوافق مع تريسولفيد النيتروز.

- في معظم الحالات ، يمكن حذف البادئة "mono" ؛ هذا ، أكثر من أي نقص في البادئة ، يدفع إلى أن هذا الأخير يجب أن يستخدم. يستمر استخدام هذه البادئة في حالة أول أكسيد الكربون نظرًا لحقيقة أن هذا الاستخدام يعود إلى بصيص الكيمياء الأول.
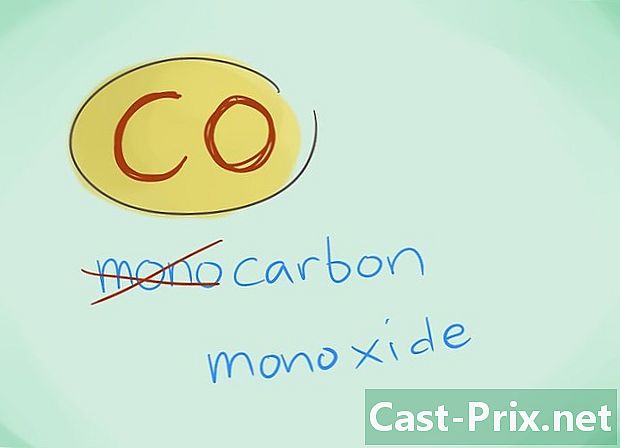
- مثال: CO سيعود إلى أول أكسيد الكربون بينما CO2 سيعين ثاني أكسيد الكربون.
- بالطبع ، تشك في أن العديد من الاستثناءات تنطبق على جميع هذه القواعد ؛ عقد على سبيل المثال ، هذه الصيغة ، CaCl2تتوقع رؤيته تسمى "ثنائي كلوريد الكالسيوم" ، وهو رقم لا. سوف يبقي مركبك ببساطة اسم كلوريد الكالسيوم.
- تجدر الإشارة أيضًا إلى أن كل هذا لا ينطبق على الكيمياء العضوية.
- القواعد التفصيلية هنا مخصصة لجمهور المبتدئين في الكيمياء والعلوم. هناك قواعد مختلفة تمامًا عندما تمر بمرحلة الكيمياء المتقدمة ، مثل قواعد التكافؤ المتغير.

