كيفية تحضير المحاليل الكيميائية
مؤلف:
Judy Howell
تاريخ الخلق:
4 تموز 2021
تاريخ التحديث:
1 تموز 2024

المحتوى
- مراحل
- الجزء 1 من 4:
استخدام نسبة الوزن / حجم النسبة - الجزء 2 من 4:
يعد حل المولي - الجزء 3 من 4:
تمييع الحلول من التركيزات المعروفة - الجزء 4 من 4:
استخدم التدابير الأمنية المناسبة - نصيحة
- تحذيرات
- العناصر الضرورية
يوجد 10 مراجع تم الاستشهاد بها في هذه المقالة ، وهي في أسفل الصفحة.
يمكنك بسهولة إعداد المحاليل الكيميائية الأساسية في المنزل وفي المختبر ، وبطرق مختلفة. سواء كنت ترغب في الحصول عليها من مركب مسحوق أو تمييع سائل آخر ، فاعلم أنه من الممكن تحديد الجرعات الصحيحة من كل مادة وحل لاستخدامها. عند التعامل مع المواد الكيميائية ، تأكد من استخدام معدات الحماية الشخصية لمنع الإصابة.
مراحل
الجزء 1 من 4:
استخدام نسبة الوزن / حجم النسبة
- 3 احسب عدد الغرامات اللازمة لصنع الحل. لحساب هذه القيمة من أجل الحصول على تركيز معين ، استخدم الصيغة التالية: # غرام = (النسبة المئوية المطلوبة) (الحجم المطلوب / 100 مل). يجب التعبير عن النسبة المئوية بالجرام والحجم بالملليتر.
- على سبيل المثال ، افترض أنك تريد تحضير محلول لكلوريد الصوديوم بنسبة 5٪ في 500 مل من الماء.
- # غرام = (5) (500 مل / 100 مل) = 25 جم.
- إذا كان كلوريد الصوديوم في حالة سائلة بالفعل ، أضف 25 مل من كلوريد الصوديوم بدلاً من 25 غرام من خليط المسحوق وطرح هذا الحجم من الحجم الكلي. بمعنى آخر ، صب 25 مل من كلوريد الصوديوم السائل في 475 مل من الماء.
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 1 / 10 /Make-Chemical-Solutions-Step-4.jpg / v4-460px-Make- الكيميائية حلول خطوة 4.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 1 / 10 / المكياج الكيميائية حلول الخطوة-4 . jpg وزن المجمع الخاص بك. بعد حساب الكتلة المطلوبة ، يجب عليك وزنه. على نطاق ومعايرة ، ضع منصة وزن وإعادة ضبطها. تزن الكمية اللازمة من المادة في غرام وتوضع جانبا.- في المثال أعلاه ، يجب أن تزن 25 غراما من كلوريد الصوديوم.
- قبل الاستمرار في إعداد الحل ، تأكد من تنظيف بقايا المسحوق في منصة الوزن.
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 7 / 7B /Make-Chemical-Solutions-Step-5.jpg / v4-460px-Make- الكيميائية حلول خطوة 5.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 7 / 7B / مستحضرات كيميائية حلول الخطوة 5 . jpg تمييع المذاب في كمية مناسبة من المذيب. ما لم يذكر خلاف ذلك ، يتم تخفيفه أو إذابة المركب عادة في الماء. باستخدام أسطوانة متدرجة (أو أداة مماثلة) ، قم بقياس كمية السائل المطلوب. خلط المذاب (في مثالنا مسحوق) في السائل حتى يذوب تماما.- على سبيل المثال ، امزج 25 غ من كلوريد الصوديوم و 500 مل من الماء للحصول على محلول 5 ٪.
- تذكر أنه إذا قمت بتخفيف مركب سائل ، قم بطرح حجم السائل المضافة من الحجم الكلي: 500 مل - 25 مل = 475 مل من الماء.
- قم بتسمية الحاوية بالإشارة إلى كل من تركيز واسم المركب: 1.5 M NaCl.
الجزء 2 من 4:
يعد حل المولي
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / أ / الإعلان /Make-Chemical-Solutions-Step-6.jpg / v4-460px-Make- الكيميائية حلول خطوة 6.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / أ / الإعلان / المكياج الكيميائية حلول الخطوة 6 jpg. تحديد الوزن الجزيئي من المجمع المستخدم. يتم التعبير عن الوزن الجزيئي بالجرام / الخلد (g / mol) ويُشار إليه في زجاجة المادة الكيميائية المستخدمة. إذا لم يتم الإشارة إلى هذه القيمة في الحاوية ، فيمكنك إجراء بحث صغير عبر الإنترنت للعثور عليها.- على سبيل المثال ، يبلغ الوزن الجزيئي لكلوريد الصوديوم (NaCl) 58.44 جم / مول.
- يمثل الوزن الجزيئي للمركب كتلة الخلد الواحد في غرام المركب نفسه.
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 7 / 7B /Make-Chemical-Solutions-Step-7.jpg / v4-460px-Make- الكيميائية حلول خطوة 7.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 7 / 7B / مستحضرات كيميائية حلول الخطوة 7 jpg. تحديد حجم الحل المطلوب في لتر. من السهل جدًا تحضير لتر واحد من المحلول ، وذلك لأن المولي يتم التعبير عنه بالشامات لكل لتر (مول / لتر). ومع ذلك ، قد تختلف جرعة المذيبات قليلاً حسب الاستخدام المقصود للمحلول. يجب عليك استخدام الحجم النهائي للسائل لحساب عدد الغرامات المطلوبة لإعداد المحلول المولي.- على سبيل المثال ، من الضروري إعداد 50 ملليلتر من المحلول بتركيز مولي قدره 0.75 NaCl.
- لتحويل البيانات بالملليتر إلى لتر ، قسّمها على 1000 واحصل على 0.05 لتر.
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 3 / 3 /Make-Chemical-Solutions-Step-8.jpg / v4-460px-Make- الكيميائية حلول خطوة 8.JPG "،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 3 / 3 / مستحضرات كيميائية حلول الخطوة 8 jpg. احسب عدد الغرامات اللازمة. لحساب هذه القيمة ، يجب عليك استخدام المعادلة التالية: عدد الغرامات = (الحجم المطلوب) (المولي المطلوب) (الوزن الجزيئي). تذكر أنه يجب التعبير عن الحجم المرغوب فيه باللتر والمول المولي لكل لتر والوزن الجزيئي بالجرام لكل مول.- على سبيل المثال ، إذا كنت ترغب في إعداد 50 ملليلتر من محلول مولار NaCl المولي 0.75 (الوزن الجزيئي: 58.44 جم / مول) ، فمن الممكن تحديد عدد غرامات كلوريد الصوديوم اللازمة.
- # غرام = 0.05 لتر * 0.75 مول / لتر * 58.44 جم / مول = 2.19 جرام كلوريد الصوديوم.
- بعد تبسيط وحدات القياس ، يجب أن تبقى جرامات المركب فقط.
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / أ / D3 /Make-Chemical-Solutions-Step-9.jpg / v4-460px-Make- الكيميائية حلول خطوة 9.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / د / D3 / مستحضرات كيميائية حلول الخطوة-9 . jpg وزن المجمع الخاص بك. على مقياس معايرة بشكل صحيح ، تزن كتلة المركب الضروري. ضع منصة وزن على المقياس وأعد ضبطها. أضف المركب في السلة حتى تحصل على الكتلة المطلوبة.- على سبيل المثال ، تزن 2.19 غرام من كلوريد الصوديوم.
- لا تنسى تنظيف المقياس عند الانتهاء من استخدامه.
-
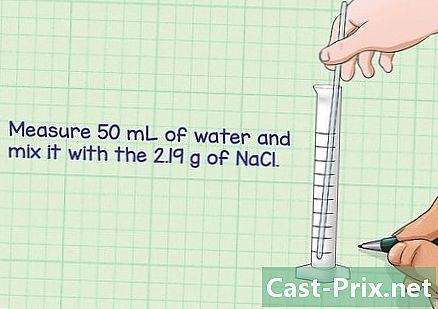
{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 9 / 90 /Make-Chemical-Solutions-Step-10.jpg / v4-460px-Make- الكيميائية حلول خطوة 10.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 9 / 90 / المكياج الكيميائية حلول الخطوة 10 . jpg تمييع مسحوق في كمية مناسبة من المذيبات. سيتم تخفيف معظم المحاليل في الماء ما لم ينص على خلاف ذلك. يجب أن يكون حجم السائل مساوياً للحجم المستخدم لحساب كتلة المادة المذابة. خلط المذاب في المذيب حتى يذوب المسحوق تماما.- على سبيل المثال ، باستخدام أسطوانة متدرجة أو أداة قياس مماثلة ، قم بقياس 50 مليلتر من الماء وحل 2.19 جرام من كلوريد الصوديوم.
- تخلط جيدا حتى يذوب المسحوق تماما.
- قم بتسمية الحاوية من خلال الإشارة إلى كل من المولية واسم المركب لتكون قادرًا على التعرف بسهولة على الحل في المستقبل.
الجزء 3 من 4:
تمييع الحلول من التركيزات المعروفة
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / ب / B1 /Make-Chemical-Solutions-Step-11.jpg / v4-460px-Make- الكيميائية حلول خطوة 11.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / ب / B1 / المكياج الكيميائية حلول الخطوة-11 jpg. تحديد تركيز كل حل. عند تخفيف الحلول ، من المهم معرفة تركيز محلول المخزون والحل الذي تريده. هذه الطريقة مناسبة لتخفيف الحلول شديدة التركيز.- لنفترض أنك تريد تحضير 75 مل من محلول بتركيز 1.5 M NaCl من محلول أولي بتركيز 5 M. بمعنى آخر ، يحتوي المحلول الأولي على تركيز 5 M وتريد تخفيفه إلى 1 ، 5 م
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 8 / 8C /Make-Chemical-Solutions-Step-12.jpg / v4-460px-Make- الكيميائية حلول خطوة 12.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 8 / 8C / مستحضرات كيميائية حلول الخطوة 12 . jpg حدد حجم الحل المراد تحضيره. يجب أن تعرف أيضًا كمية السائل الذي تريد الحصول عليه. ستحتاج إلى حساب مقدار حل العمل المطلوب لتخفيف محلول المخزون حتى يتم تحقيق التركيز والحجم المطلوبين.- يتكون المثال الموصوف أعلاه من إعداد 75 مل من محلول يحتوي على تركيز 1.5 M NaCl من محلول 5 M ، وفي هذه الحالة يكون الحجم النهائي 75 مل.
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 9 / 9B /Make-Chemical-Solutions-Step-13.jpg / v4-460px-Make- الكيميائية حلول خطوة 13.JPG "،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 9 / 9B / مستحضرات كيميائية حلول الخطوة-13 . jpg حساب حجم الحل المركزة لإضافتها إلى الحل النهائي. لهذه العملية ، يجب عليك استخدام الصيغة التالية: V1C1V =2C2، مع الخامس1 الحجم الأولي للحل و C1 تركيزه ، V2 هو المجلد النهائي الذي تريد الحصول عليه و C2 التركيز المطلوب.- يتكون المثال الموصوف أعلاه من إعداد 75 مل من محلول يحتوي على تركيز 1.5 M NaCl من محلول 5 M ، وفي هذه الحالة يكون الحجم النهائي 75 مل.
- لحساب الحجم المطلوب للسائل الأولي ، تحتاج إلى تغيير تخطيط المصطلح وحل المعادلة V1: الخامس1 = (الخامس2C2) / C1
- V1 = (الخامس2C2) / C1 = (0.075 لتر * 1.5 متر) / 5 مليون = 0.0225 لتر.
- حوّل القيمة إلى لتر بالملليتر ، واضربها في ميل واحد: 22.5 مل.
-
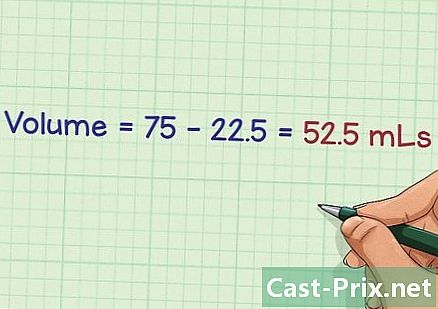
{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 8 / 8A /Make-Chemical-Solutions-Step-14.jpg / v4-460px-Make- الكيميائية حلول خطوة 14.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 8 / 8A / مستحضرات كيميائية حلول الخطوة 14 . jpg طرح حجم الحل الأولي من وحدة التخزين النهائية المتوقعة. عند تخفيف محلول المخزون ، تحتاج إلى التأكد من حصولك على الحجم النهائي. عن طريق طرح حجم محلول الأساس المراد إضافته ، فإنك تضمن أن يتم التخفيف بشكل صحيح.- في مثالنا ، يجب أن تحصل على محلول نهائي يبلغ 75 مل عن طريق إضافة 22.5 مل من السائل لتخفيفه. وبالتالي يتم الحصول على 75-22.5 = 52.5 مل. يمثل هذا الحجم مقدار محلول التخفيف المستخدم.
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / ب / دينار بحريني /Make-Chemical-Solutions-Step-15.jpg / v4-460px-Make- الكيميائية حلول خطوة 15.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / ب / دينار بحريني / المكياج الكيميائية حلول الخطوة 15 jpg. أضف حجم محلول المخزون إلى محلول التخفيف. باستخدام أسطوانة متدرجة ، أو جهاز قياس مماثل ، قم بقياس حجم محلول المخزون وإضافته مع حجم محلول التخفيف.- باستخدام نفس المثال ، قم بقياس 22.5 مل من المحلول الأولي بتركيز 5 M NaCl واسكب 52.5 مل من الماء. مزيج للحصول على حل متجانس.
- قم بتسمية الحاوية بالإشارة إلى كل من تركيز واسم المركب: 1.5 M NaCl.
- تذكر أنه إذا قمت بتخفيف حمض في الماء ، فمن المهم أن تضيف الماء دائمًا إلى الماء ، وليس العكس.
الجزء 4 من 4:
استخدم التدابير الأمنية المناسبة
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / د / مدافع /Make-Chemical-Solutions-Step-16.jpg / v4-460px-Make- الكيميائية حلول خطوة 16.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / د / مدافع / مستحضرات كيميائية حلول الخطوة 16 . jpg استخدام معدات الحماية الشخصية. عند التعامل مع المواد الكيميائية والحلول العدوانية ، من الضروري حماية جسمك من التلف. ارتداء معطف المختبر والأحذية المغلقة وحماية العين والقفازات أمر مهم للغاية.- ارتداء معطف المختبر مصنوعة من مواد غير قابلة للاشتعال.
- يجب أن تحتوي نظارات السلامة على شاشات جانبية تحمي العينين من البقع على الوجه.
-

{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / ت / ج /Make-Chemical-Solutions-Step-17.jpg / v4-460px-Make- الكيميائية حلول خطوة 17.jpg و"،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / ت / ج / المكياج الكيميائية حلول الخطوة 17 jpg. العمل في منطقة جيدة التهوية. يمكن تشكيل الغازات المتطايرة أثناء خلط المحاليل وانتشارها في الهواء. لا يمكن التحكم في بعض المواد الكيميائية إلا تحت غطاء الدخان. إذا كنت في المنزل ، فافتح النوافذ وقم بتشغيل مروحة لضمان دوران الهواء. -
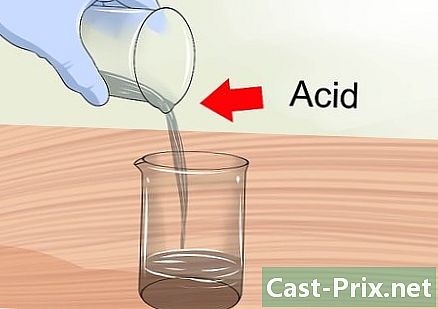
{ "SmallUrl": "الشبكي: / / www..com / images_en / الإبهام / 7 / 7F /Make-Chemical-Solutions-Step-18.jpg / v4-460px-Make- الكيميائية حلول خطوة 18.JPG "،" bigUrl ":" الشبكي: / / www..com / images_en / الإبهام / 7 / 7F / مستحضرات كيميائية حلول الخطوة 18 . jpg أضف الماء إلى الماء ، وليس العكس. عند تخفيف الأحماض القوية ، يجب عليك دائمًا صبها في الماء ، وليس العكس. توليفة من هاتين المادتين تولد تفاعل طارد للحرارة (الذي يطلق الحرارة) ويمكن أن يؤدي إلى انفجار إذا تمت إضافة الماء إلى الحمض.- راجع جميع احتياطات السلامة عند التعامل مع الحلول الحمضية.
نصيحة

- القيام ببعض الأبحاث قبل البدء في هذه التجربة الكيميائية. المعرفة قوة!
- استخدام المنتجات المنزلية كلما كان ذلك ممكنا. لا تحاول أن تفعل أي شيء غير عادي. إذا كنت قلقًا من أن نتائج تجربتك قد تكون خطيرة ، فستكون هذه هي الحالة بالتأكيد!
تحذيرات
- لا تخلط الأمونيا مع التبييض.
- إذا لزم الأمر ، وارتداء معدات واقية ، ونظارات السلامة ، ساحة بلاستيكية وقفازات النيوبرين.
العناصر الضرورية
- توازن ميكانيكي أو إلكتروني دقيق لتحديد الكتلة. على سبيل المثال ، يمكنك استخدام مقياس المطبخ
- معدات الزجاج تخرج. ابحث في قسم السلع المنزلية في محلات السوبر ماركت. تتميز المعدات الزجاجية بمجموعة متنوعة من الأشكال والأحجام. تعتبر العناصر البلاستيكية الشفافة اختيارًا ممتازًا ولكنها لا تدعم درجات الحرارة العالية