كيفية العثور على عدد البروتونات والإلكترونات والنيوترونات
مؤلف:
Roger Morrison
تاريخ الخلق:
27 شهر تسعة 2021
تاريخ التحديث:
1 تموز 2024

المحتوى
في هذه المقالة: احسب عدد البروتونات والإلكترونات والنيوترونات احسب عدد الإلكترونات في أيونات 8
تمثل النيوترونات والإلكترونات والبروتونات الجزيئات الرئيسية الثلاثة التي تتكون منها الذرة. كما يمكنك أن تخمن ، فإن البروتونات لها شحنة موجبة ، والإلكترونات تحمل شحنة سالبة ، والنيوترونات مجرد جزيئات محايدة. كتلة الإلكترونات صغيرة جدا. ومع ذلك ، النيوترونات والبروتونات لها كتل مماثلة. للعثور على عدد البروتونات والإلكترونات والنيوترونات الموجودة في الذرة ، يكفي الرجوع إلى الجدول الدوري للعناصر ، وتسمى أيضًا جدول مندليف.
مراحل
الجزء 1 احسب عدد البروتونات والإلكترونات والنيوترونات
-
الحصول على جدول دوري للعناصر. سيساعدك هذا الجدول في العثور على عدد البروتونات والإلكترونات والنيوترونات في العنصر. إنه جدول يعرض العناصر وفقًا لتركيبها الذري. يميز رمز اللون العناصر المختلفة. يتم تعريف كل عنصر برمز يتكون من حرف أو حرفين أو ثلاثة أحرف. يوضح الجدول أيضًا معلومات أخرى مثل الكتلة الذرية والرقم الذري لكل عنصر.- يمكنك العثور على هذا المخطط إما بالبحث على الإنترنت أو في كتاب الكيمياء.
- في الامتحانات ، يُسمح لك عادة باستخدام جدول دوري للعناصر.
-
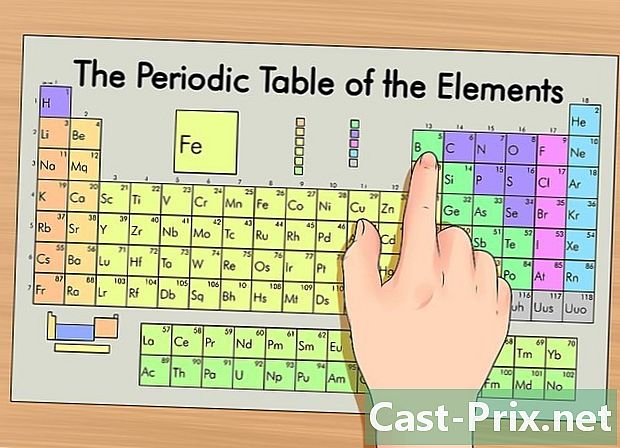
تحديد العنصر الخاص بك على الجدول الدوري. في الجدول ، يتم تجميع العناصر وفقًا لعددهم الذري. وهي مقسمة إلى ثلاث مجموعات رئيسية: المعادن والفلزات والمعدنية (شبه المعادن). وتشمل المجموعات الأخرى المعادن القلوية ، الهالوجينات والغازات النبيلة.- من الأسهل تحديد موقع عنصر في المصفوفة باستخدام مجموعته (العمود) أو الفترة (الصف).
- إذا كنت لا تعرف خصائص العنصر ، يمكنك البحث عن الرمز الخاص به.
-
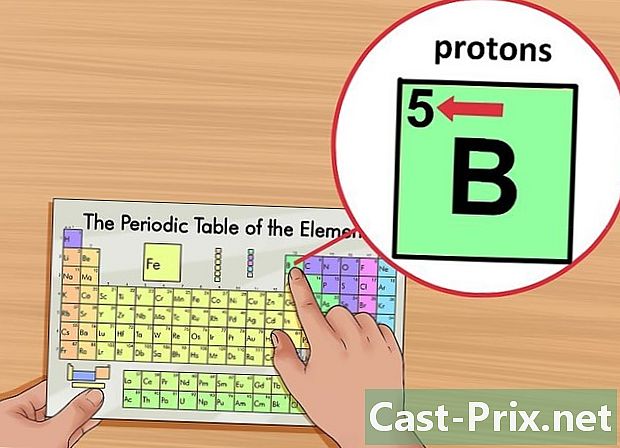
تحديد موقع العدد الذري للعنصر. تم وضع علامة على هذا الرقم في الركن الأيسر العلوي من المربع ، أعلى رمز العنصر. يمنحك الرقم الذري عدد البروتونات التي تشكل العنصر المعني.- على سبيل المثال ، العدد الذري للبورون (B) هو 5. لذلك ، له 5 بروتونات.
-

تحديد عدد الإلكترونات. تشتمل نواة الذرة على بروتونات ذات جسيمات موجبة الشحنة. الإلكترونات هي جزيئات سالبة الشحنة. لذلك ، فإن عدد البروتونات والإلكترونات لعنصر محايد سيكون هو نفسه.- على سبيل المثال ، يحتوي البورون (B) على عدد ذري 5 ، لذلك يحتوي على 5 بروتونات و 5 إلكترونات.
- ومع ذلك ، إذا كان أيون موجبًا أو سالبًا ، فسيكون عدد البروتونات وعدد الإلكترونات مختلفًا. سيكون لديك لحسابهم. يشار إلى تهمة الأسد في طباعة صغيرة من قبل الأس بعد البند المقابل.
-

ابحث عن الكتلة الذرية للعنصر. تتيح لك هذه الخطوة العثور على عدد النيوترونات. سوف تحتاج أولاً إلى تحديد الكتلة الذرية أو الوزن الذري للعنصر. يمثل هذا المسند متوسط كتلة ذرات هذا العنصر. وهي منقوشة تحت رمز العنصر.- تأكد من تقريب الكتلة الذرية للعنصر إلى أقرب عدد صحيح. وبالتالي ، تمتلك البورون كتلة ذرية تبلغ 10.811 ، ولكن سيتعين عليك الانتقال إلى 11.
-

قم بعمل الفرق بين العدد الذري والكتلة الذرية. لحساب عدد النيوترونات ، عليك أن تفرق بين العدد الذري والكتلة الذرية. لا تنس أنك تعرف بالفعل الرقم الذري. انها ببساطة مطابقة لتلك التي البروتونات.- للبورون ، سيكون لديك: 11 (الكتلة الذرية) - 5 (العدد الذري) = 6 نيوترونات
الجزء 2 حساب عدد الإلكترونات في أيون
-

العثور على شحنة كهربائية من أيون. يظهر هذا الرقم بواسطة الأس بعد رمز العنصر. الأيونات عبارة عن ذرة ذات شحنة موجبة أو سالبة بسبب إضافة أو قمع الإلكترونات. لا يختلف عدد البروتونات في الذرة. ومع ذلك ، في أيون ، يتم تغيير عدد الإلكترونات.- نظرًا لأن للإلكترون شحنة سالبة ، يصبح موجبًا بعد إزالة إلكترون واحد أو أكثر. من ناحية أخرى ، سيكون لإضافة الإلكترونات تأثير جعل الشحنة سالبة.
- على سبيل المثال ، تحميل N هو -3. من ناحية أخرى ، فإن Ca هو +2.
- لا تنس أن هذا الحساب ليس ضروريًا ، إذا كان رمز العنصر لا يتبعه الأس.
-

انزع الشحنة من الرقم الذري. في الأصل ، أيون ذو شحنة موجبة هو ذرة فقدت الإلكترونات. للعثور على عدد الإلكترونات ، عليك طرح الشحنات الإضافية من الرقم الذري. إذا كان الأسد موجبًا ، يكون عدد البروتونات أكبر من عدد الإلكترونات.- على سبيل المثال ، تكون تهمة Ca هي +2. نتيجة لذلك ، فقد إلكترونين مقارنة بحالته الأولية. العدد الذري للكالسيوم يساوي 20 ، وبالتالي فإن الأسد لديه 18 إلكترون.
-

أضف شحنة إلى العدد الذري للأيونات السالبة. عندما يتم شحن أيونات سالبة ، يكون للاتومي إلكترونات إضافية. لحساب إجمالي عدد الإلكترونات ، يكفي إضافة عدد الشحنات الإضافية إلى الرقم الذري. إذا كان الأسد سالبًا ، فلديه بروتونات أقل من الإلكترون.- على سبيل المثال ، تحميل N هو -3. لذلك ، فإنه يحمل 3 إلكترونات أخرى مقارنة بحالته الأولية. العدد الذري لازوت هو 7. لذلك ، يحتوي هذا الأيون على 10 إلكترونات.